本维莫德乳膏说明书
核准日期:2019年5月29日 版本号:43002-I-2101
修订日期:(1)2020年12月25日;(2)2021年12月15 日
外
本维莫德乳膏说明书
请仔细阅读说明书并在医师指导下使用
【药品名称】
通用名称:本维莫德乳膏
商品名称:欣比克
英文名称:Benvitimod Cream
汉语拼音:Benweimode Rugao
【成份】
本品活性成分为本维莫德。
化学名称:5-[(E)-2-苯乙烯基]-2-异丙基-1,3-苯二酚
化学结构式: 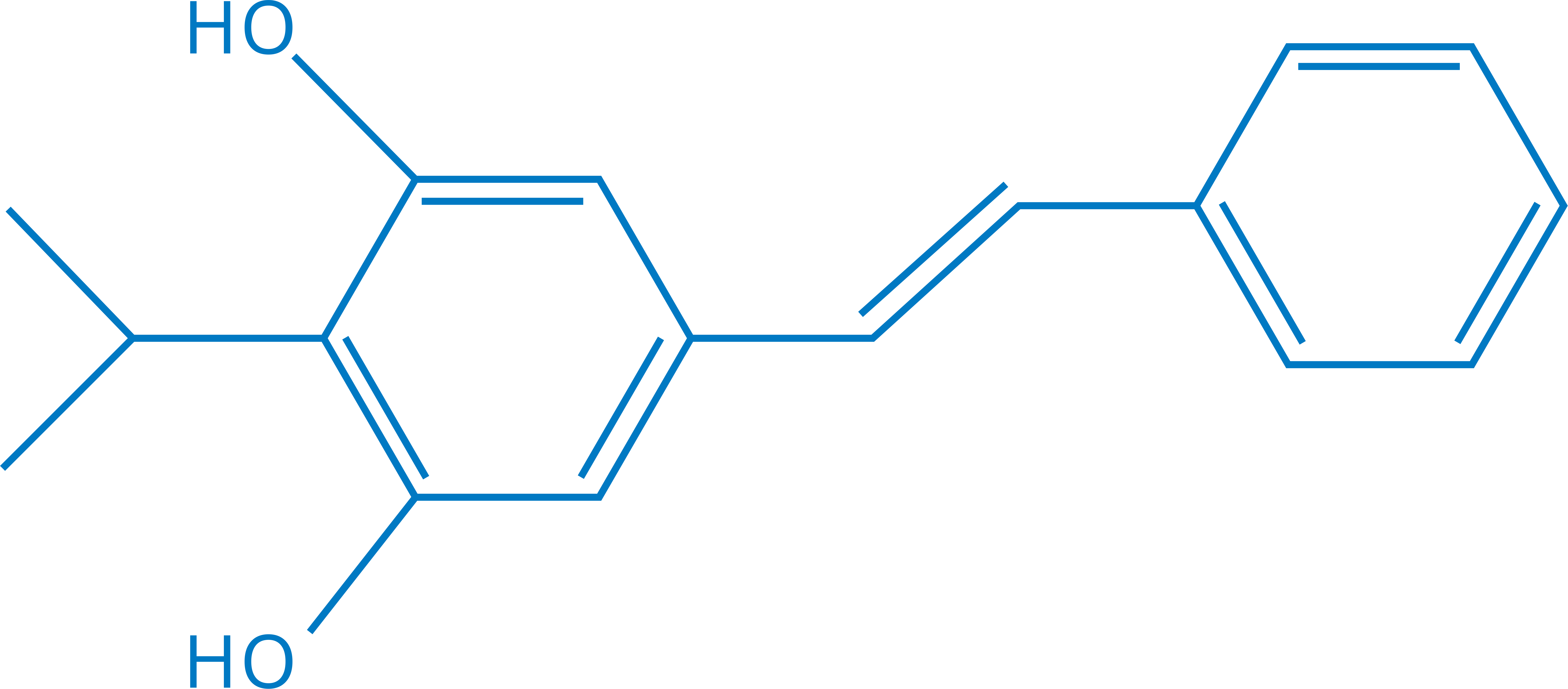
分子式:C17H18O2 分子量:254.32
辅料:十六醇、白凡士林、轻质液状石蜡、单双硬脂酸甘油酯、丙二醇、聚山梨酯80(Ⅱ)、聚乙二醇十六十八醚、二丁基羟基甲苯、依地酸二钠、羟苯乙酯和纯化水。
【性状】本品为类白色乳膏。
【适应症】本品用于适合局部治疗的成人轻至中度稳定性寻常型银屑病。
【规格】(1)10g:0.1g(1%) (2)20g:0.2g(1%) (3)30g:0.3g(1%)
【用法用量】
皮肤局部外用,每日两次,早晚各一次,均匀涂抹于患处,形成一薄层即可。每日最大使用剂量不超过6g,治疗面积不应超过体表面积的10%。患处皮肤涂布本品后严禁日光照射,在自然光照下也需注意采取避光措施。
本品连续使用超过12周的安全有效性尚未确立。临床用药总时间最长不得超过12周。本品停药后重复使用的安全有效性尚未确立,不推荐重复使用。
本品不可用于头面部、口周及眼睑部、腹股沟、肛门生殖器等部位。用药后请立即洗手。
【不良反应】
因临床试验条件各异,故在一项药物临床试验中观察到的药物不良反应发生率不能与其他药物临床试验的不良反应发生率相比较,临床实际应用中不良反应发生率与药物临床试验中不良反应发生率也可能会有一定差异。
目前,1093例成人轻至中度稳定性寻常型银屑病患者的临床试验,其中615例患者应用了本维莫德乳膏治疗,345例应用了12周治疗,59例应用了52周治疗,结果显示,约38.7%的患者出现了与药物相关的不良反应。本维莫德乳膏常见不良反应为用药部位的瘙痒、毛囊炎、接触性皮炎、丘疹、过敏性皮炎、疼痛、红斑、皮肤水肿、皮疹、色素异常、皮炎、皮肤干燥等,多为一过性并呈轻中度,多发于用药后14天之内,多数皮肤局部不良反应不需用药可自行好转。其他组织器官和系统性不良反应少见。观察到的系统不良事件包括感染及浸染类疾病(流感、尿路感染、上呼吸道感染、鼻咽炎、发热、皮肤感染、毛囊炎等)、转氨酶升高、腹泻、上腹痛、胸闷、哮喘、频发室早、频发房早等。无死亡发生,试验过程中出现4例(0.5%)严重不良反应,分别为2例接触性皮炎、1例接触性皮炎合并药疹、1例多形性红斑。
基于多个临床试验的合并分析不良反应发生率(十分常见≥10%;常见≥1%,<10%;少见≥0.1%,<1%)如下表(单个反应按照发生频率从高到低的降序排列。每个频率组中,不良反应按照严重程度降序排列)。
表1不良反应列表
系统组织器官 | 发生频率 | 不良反应 |
皮肤及皮下组织类疾病 | 十分常见 | 瘙痒 |
常见 | 毛囊炎、接触性皮炎、过敏性皮炎、丘疹、疼痛、皮疹、红斑、皮肤水肿、色素异常、皮炎、皮肤干燥 | |
少见 | 皮肤刺激、皮肤灼烧感、荨麻疹、毛囊及毛囊旁角化过度、皮肤剥脱、脓疱疹、潮红、毛发生长异常、湿疹、痤疮、水疱、苔藓样变、掌跖红肿疼痛综合征、皮肤乳头状瘤 | |
感染及侵染类疾病 | 少见 | 脓疱疹、毛囊炎 |
全身性疾病 | 少见 | 胸部不适 |
胃肠系统 | 少见 | 上腹痛 |
实验室检查 | 少见 | 白细胞计数升高、嗜酸性粒细胞计数升高 |
【禁忌】
1、对本维莫德或乳膏中其他任何成分过敏者禁用。
2、妊娠、计划妊娠及哺乳期妇女禁用。
3、点滴状,红皮病型、关节病型和脓疱型银屑病患者禁用。
【注意事项】
1、本品仅供皮肤局部外用,不可用于头面部、口周及眼睑部、腹股沟、肛门生殖器等部位。用药后请立即洗手。
2、每日使用最大剂量不能超过6g。治疗皮损面积不应超过体表面积的10%。
3、本品不能用于损伤皮肤,不能封闭敷裹,不能用于伴有溃疡的粘膜或者用于皮肤褶皱处。
4、使用本品治疗时,医生应该建议患者涂布本品后应避免暴露于自然光或人工光下,或应采用避光措施。
5、本品连续使用超过12周的安全有效性尚未确立。临床用药不应超过12周。
6、使用后请拧紧瓶盖,以防污染。
7、本品性状发生改变时请勿使用。
8、有接触性皮炎史者慎用。
9、请在医生指导下使用本品,如出现严重不良反应请立即停止使用并及时咨询医生。
10、部分患者使用本品后可能会产生一过性皮肤刺激反应,多在用药后两周内发生,大多数无需处理,随用药时间延长可逐渐消失,如果皮肤刺激反应程度较重或用药两周后仍未消退,建议停用本品并咨询医生。
11、酒精依赖者、经常使用中草药或镇静剂、安眠药、安定剂及其它成瘾性药物者慎用。
12、肝肾功能损害的患者:没有对产品治疗伴有严重肾功能不全或重度肝脏病患者的安全性和有效性进行评估。
13、请将本品放在儿童不能接触的地方。
14、局部使用本品治疗银屑病,在治疗停止后可能会发生银屑病复发,复发后使用本品再治疗的安全有效性尚未确立。
【孕妇及哺乳期妇女用药】
孕妇:本品尚未在孕妇中进行临床试验,孕妇用药的安全性尚未确立。
动物实验结果显示,以30mg/kg/日的剂量对大鼠和以6mg/kg/日的剂量对兔皮下注射本品时,会产生胚胎减少和骨骼发育迟缓等生殖毒性。因此,妊娠和计划妊娠的妇女禁止使用本品。
哺乳期妇女:本品尚未在哺乳期妇女中进行临床试验,哺乳期妇女用药的安全性尚未确立。
动物实验结果显示,本品会通过乳汁分泌。因此,哺乳期妇女应慎用本品,只有在充分权衡且治疗获益明显大于风险的前提下,方可考虑使用本品,使用本品时应停止哺乳。
【儿童用药】 尚未在18岁以下患者中进行本维莫德乳膏治疗银屑病的有效性和安全性研究,因此,18岁以下患者不得使用本品。
【老年用药】本维莫德乳膏临床研究未包括足够数量的65岁及以上的受试者,不能确定65岁及以上患者与年轻患者是否有不同的反应。
【药物相互作用】尚不明确。未进行该项试验且无可靠参考文献。
【药物过量】尚不明确。未进行该项试验且无可靠参考文献。请严格按照说明书推荐的用法和用量使用。
【临床试验】在两项多中心、随机、双盲的Ⅱ期和Ⅲ期临床试验中,其中Ⅱ期为安慰剂对照,Ⅲ期为安慰剂和阳性药对照,对583例18~65岁轻至中度银屑病患者使用本维莫德乳膏进行了有效性评价。受试者中轻度银屑病患者(1%<皮损面积≤5%)占57%,中度银屑病患者(5%<皮损面积≤10%)占43%。入选患者的银屑病皮损面积与严重性评分(PASI)为0.9~17.9,研究者总体评分(PGA)2~5。(PGA评分:2为轻度、3为中度、4为中至重度、5为重度)。试验主要疗效终点以治疗结束时银屑病皮损面积与严重性评分下降75%(PASI 75)的受试者比例及研究者总体评价(PGA)降至0(消退)或1(基本消退)的受试者比例。
在Ⅱ期临床试验中,354例患者按照1:1:1随机分配至0.5%、1%本维莫德乳膏或安慰剂组接受治疗。根据皮损面积用药,每日早晚各一次,连续治疗8周。疗效终点评价结果显示,与安慰剂组比较,0.5%和1%的本维莫德剂量组有显著疗效,结果见表2。
表2 Ⅱ期临床试验疗效结果
疗效指标 | 1%本维莫德组(N=120) | 安慰剂组(N=115) | 0.5%本维莫德组(N=119) |
PASI75应答率 | 46%* | 14% | 49%* |
PGA应答率 | 74%* | 31% | 72%* |
*与安慰剂比较统计差别显著(p<0.05)
在Ⅲ期临床试验中,686例患者按2:1:1比例随机分配至1%本维莫德乳膏、安慰剂或卡泊三醇组接受治疗,根据皮损面积每日2次用药,以治疗12周PASI75应答率和PGA应答率为主要疗效指标。结果显示,1%本维莫德乳膏外用对寻常型银屑病有良好疗效。治疗12周,PASI75应答率优于卡泊三醇组,显著优于安慰剂组,研究者总体评价PGA显著优于安慰剂组。对治疗结束时银屑病皮损面积与严重性评分下降90%(PASI90)和治疗结束时银屑病皮损面积与严重性评分下降50%患者比例(PASI50)进行分析,结果显示本维莫德组与安慰剂和卡泊三醇组相比,具有统计意义差别,结果见表3。
表3 Ⅲ期临床试验疗效结果
疗效指标 | 1%本维莫德组(N=344) | 安慰剂组(N=173) | 卡泊三醇组(N=169) |
PASI75应答率 | 50%*† | 14% | 37%* |
PGA应答率 | 66%* | 34% | 64%* |
PASI90应答率 | 33%*† | 4% | 20%* |
PASI50应答率 | 68%* | 41% | 70%* |
*与安慰剂比较统计差别显著(p<0.05) †与卡泊三醇比较统计差别显著(p<0.05)
对Ⅲ期临床试验中部分使用本维莫德乳膏治愈的患者进行了为期一年的长期用药临床研究,以观察缓解时间、复发情况和有效性。试验期间如果患者银屑病症状和体征再次出现复发,则按需使用本品。研究结果显示,至试验期末,59例完成一年时间试验的受试者中有30例患者(51%)复发,29例未复发。从治愈至复发时间缓解期中位数约为36周(9个月)。复发的患者重新使用1%本维莫德进行治疗后,PASI积分随治疗时间逐步下降,至试验结束时银屑病面积和严重性积分减少≥75%的患者达40%。
【药理毒理】
药理作用:本维莫德治疗银屑病的具体作用机制尚不清楚。药理研究显示,本维莫德可抑制淋巴细胞蛋白质酪氨酸激酶活性;对与银屑病相关的炎症性细胞因子的释放、炎症细胞迁移和浸润、角质形成细胞的非正常分化和增生、新生血管形成和血管扩张均有抑制作用。
毒理研究
遗传毒性:本维莫德Ames试验、中国仓鼠肺细胞(CHL)染色体畸变试验和小鼠体内微核试验结果均为阴性。
生殖毒性:雄性大鼠从交配前28天至交配成功,雌性大鼠从交配前14天至妊娠后第6天,每日皮下注射本维莫德3、10和30mg/kg(上述剂量组评价AUC(0~∞)为413.1、726.3和1914.4ng·h/ml,分别是人体经皮给药药代试验最大剂量5.7㎎/㎝²的67.7、119.1和313.8倍)。30mg/kg剂量下雄性大鼠生育力未见明显不良影响,但该剂量下可导致母鼠体重、胎盘重量降低,胎仔活胎数减少和吸收胎数增加;雌性大鼠生育力和早期胚胎发育的未见明显毒性反应剂量(NOAEL)为10mg/kg。
大鼠于妊娠第6~15天连续皮下注射本维莫德3、10和30mg/kg。各组母鼠给药期间均可见注射部位皮肤局部红肿和轻度溃疡;10mg/kg以上剂量组母鼠可见体重增长减缓;30mg/kg组胎仔可见活胎数明显减少,平均身长明显降低,第2、5、6胸骨骨化不全或缺失;大鼠胚胎-胎仔发育的NOAEL为10mg/kg。
兔于妊娠第6~18天连续皮下注射本维莫德6和20mg/kg(上述剂量组评价AUC(0~∞)为689.9和1263.3ng·h/ml,分别是人体经皮给药药代试验最大剂量5.7㎎/㎝²的113.1和207.1倍)。6mg/kg以上剂量组母兔可见体重减轻和摄食量减少,胎仔可见活胎率降低、骨骼发育延迟;20mg/kg可导致母兔流产率增加、胎仔全部死亡;兔胚胎-胎仔发育的NOAEL为2mg/kg。
大鼠于妊娠第6天至分娩后第21天连续皮下注射本维莫德3、10和30mg/kg(上述剂量组评价AUC(0~∞)为413.1、726.3和1914.4ng·h/ml,分别是人体经皮给药药代试验最大剂量5.7㎎/㎝²的67.7、119.1和313.8倍)。10mg/kg以上剂量组母鼠可见剂量相关的哺乳期摄食量降低,30mg/kg组可导致母鼠体重增长减慢,孕鼠可见难产死亡;10mg/kg以上剂量可导致F1 代出生死亡率增加、外观畸形率增加、体重增长降低、发育期摄食量减少及雌雄生殖器官重量降低,3mg/kg以上剂量可导致F1代雄鼠生育率和雌鼠妊娠率降低,30mg/kg剂量下还可见吸收胎率和着床后丢失率增加、活胎(F2代)率降低。
本维莫德可通过母鼠乳汁分泌。
致癌性:本维莫德尚未进行致癌性试验,其长期使用的致癌性风险尚不明确。
光毒性:在豚鼠皮肤光毒性试验中,2%本维莫德乳膏未见明显光毒性。
【药代动力学】
12例轻至中度银屑病患者使用本维莫德乳膏1.8mg/cm2(每次使用0.7-3g),每天2次,持续42天,全身吸收有限。
体外试验结果显示,本维莫德血浆蛋白结合率可高达90.5%。
大鼠皮下注射本维莫德9㎎/㎏后,脏器中肝、肾、脾、胃、甲状腺、卵巢、胰腺、皮肤中均有分布。给药后120小时,尿液和粪便中原形药物累积排泄量为20.2%,代谢产物主要通过粪便、胆汁和尿液排出,大部分药物以结合形式存在。
【贮藏】遮光,密封保存。请置于儿童不易触及之处。
【包装】1支/盒。 【有效期】24个月。
【执行标准】YBH15182021 【批准文号】国药准字H20190026
生产企业:广东中昊药业有限公司 生产地址:广东省中山市火炬开发区华佗路1号
邮政编码:528400 电话号码:0760-89928730
传真号码:0760-89928717 购药咨询电话:020-66312155/020-66312150
网 址:http://www.zhonghaopharma.com/
上市许可持有人:广东中昊药业有限公司 地址:广东省中山市火炬开发区华佗路1号
微信二维码: